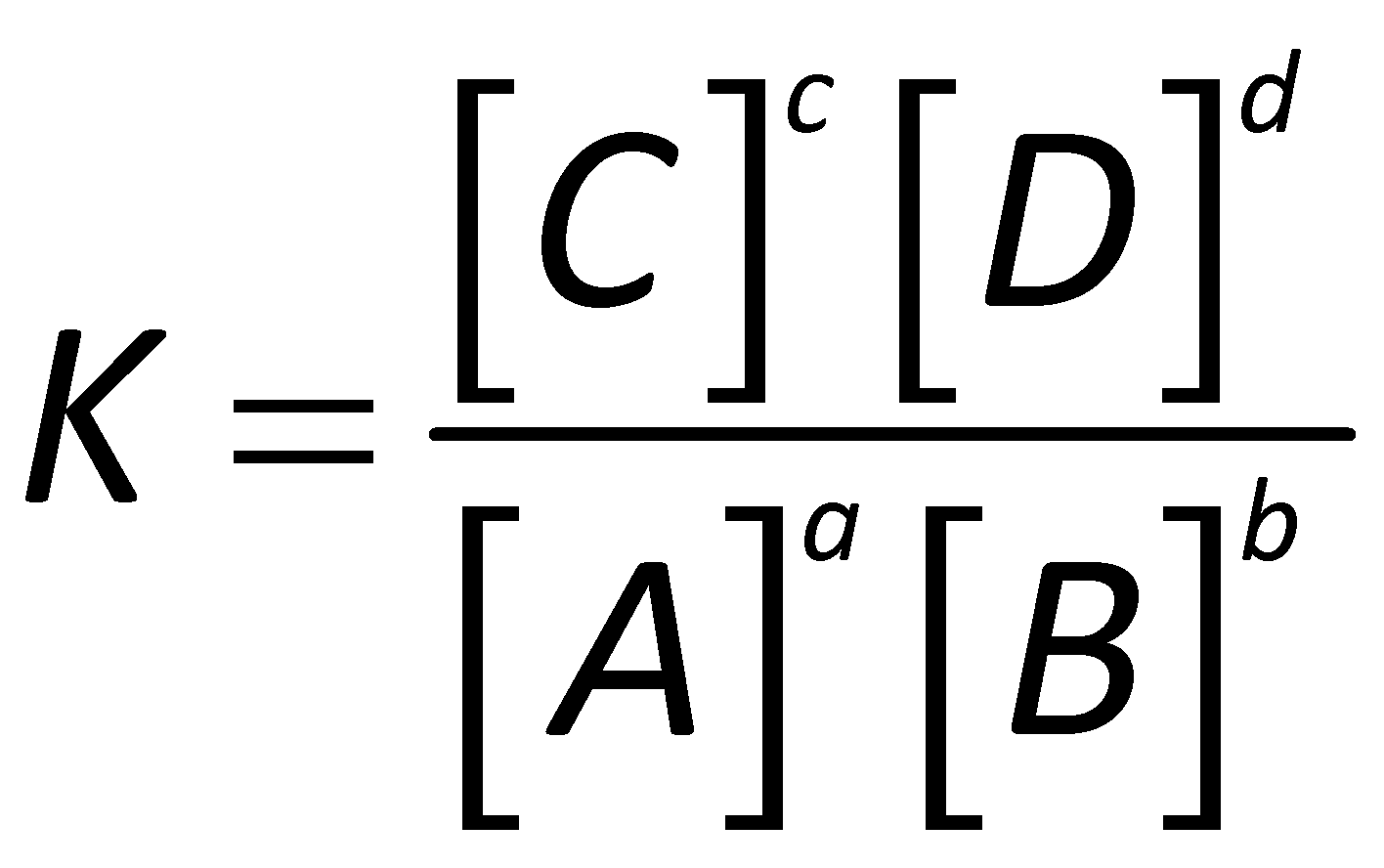acideUn acide est une espèce susceptible de céder un ou plusieurs protons. |
ampholyteUne ampholyte (ou amphotère) est une espèce possédant les propriétés d’un acide et d’une base. |
amphotèreUne amphotère (ou ampholyte) est une espèce possédant les propriétés d’un acide et d’une base. |
baseUne base est une espèce susceptible de capter un ou plusieurs protons. |
constante d'équilibreUne constante d'équilibre caractérise l'état d'équilibre d'une réaction chimique. Elle représente donc un état qui ne peut pas évoluer de manière spontanée. La valeur de la constante d'équilibre dépend uniquement de la réaction chimique considérée et de la température. Les constantes d'équilibre sont généralement données à 25 °C. Soit la réaction suivante et la constante d'équilibre associée
|
Couple rédoxÀ tout oxydant (respectivement réducteur) correspond un réducteur (respectivement oxydant) pour former un couple oxydant/réducteur (couple rédox), noté Ox/Red. Les espèces Ox et Red sont dites conjuguées. À chaque couple rédox est associé une demi-équation d'oxydoréduction de la forme: |
Demi-équationUne demi-équation redox est l'équation symbolisant l'échange d'électron(s) au sein d'un couple rédox (Ox1/Red1) avec n le nombre d'électrons échangés
|
dilution |
dissociationLa dissociation d'une espèce en solution aqueuse correspond à la séparation en ces ions (anions/cations) constitutifs |
dissolutionLa dissolution est le processus physico-chimique par lequel un soluté incorporé dans un solvant (on dit que le soluté est dissous) forme un mélange homogène appelé solution. Formellement, la dissolution est définie comme le mélange de deux phases avec formation d'une nouvelle phase homogène. Le soluté peut être à l'état solide, liquide ou gazeux. La solution obtenue peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz). La dissolution des solides ioniques dans l'eau s'effectue en trois étapes : - dissociation - solvatation - dispersion. |