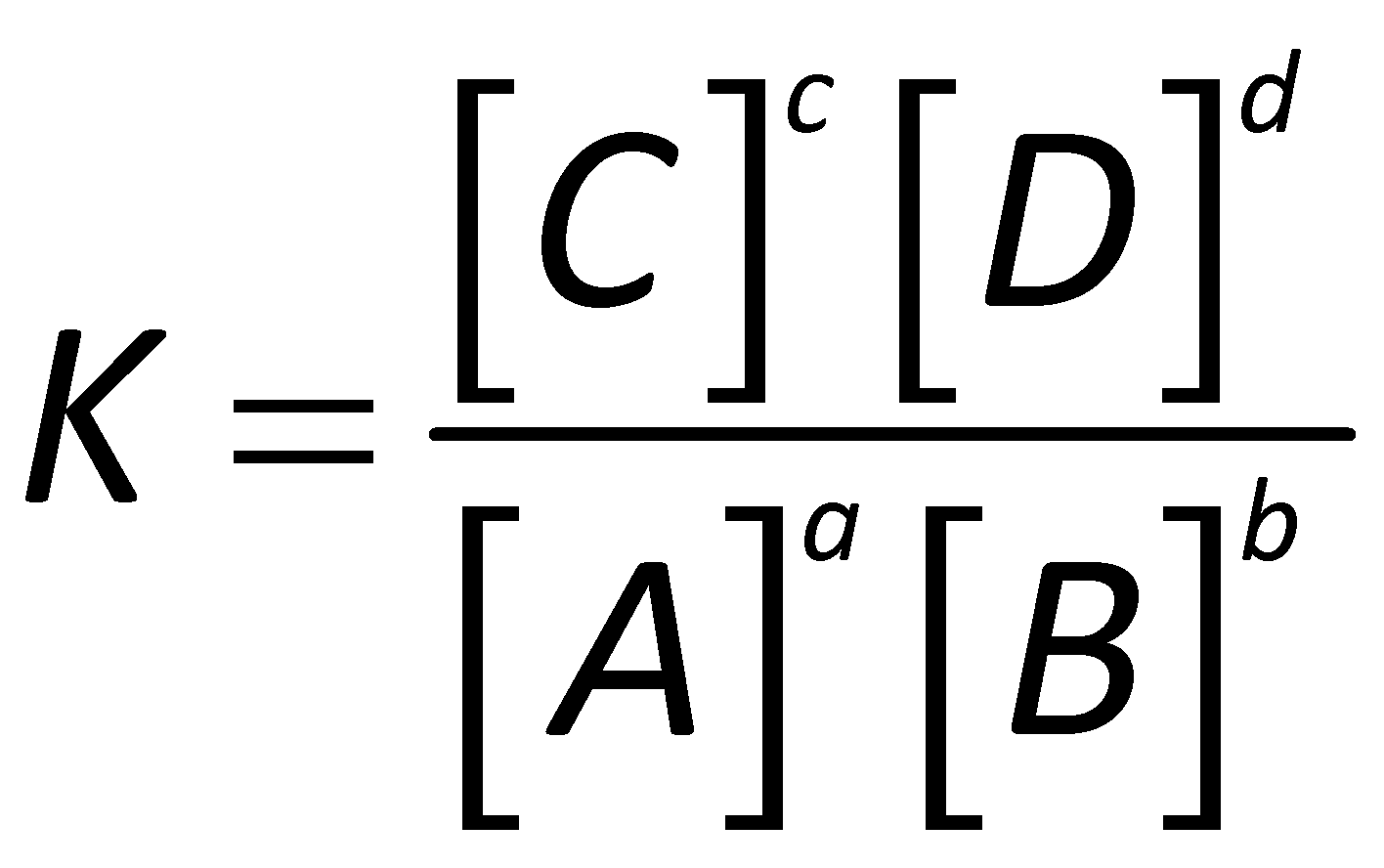Glossaire des définitions importantes
Vous retrouverez ici les définitions des termes utilisés dans les différents chapitres traités
Spécial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | Tout
A |
|---|
acideUn acide est une espèce susceptible de céder un ou plusieurs protons. | |
ampholyteUne ampholyte (ou amphotère) est une espèce possédant les propriétés d’un acide et d’une base. | |
amphotèreUne amphotère (ou ampholyte) est une espèce possédant les propriétés d’un acide et d’une base. | |
B |
|---|
baseUne base est une espèce susceptible de capter un ou plusieurs protons. | |
C |
|---|
Couple rédoxÀ tout oxydant (respectivement réducteur) correspond un réducteur (respectivement oxydant) pour former un couple oxydant/réducteur (couple rédox), noté Ox/Red. Les espèces Ox et Red sont dites conjuguées. À chaque couple rédox est associé une demi-équation d'oxydoréduction de la forme: | |
D |
|---|
Demi-équationUne demi-équation redox est l'équation symbolisant l'échange d'électron(s) au sein d'un couple rédox (Ox1/Red1) avec n le nombre d'électrons échangés
| |
dilution | |
dissociationLa dissociation d'une espèce en solution aqueuse correspond à la séparation en ces ions (anions/cations) constitutifs | |
dissolutionLa dissolution est le processus physico-chimique par lequel un soluté incorporé dans un solvant (on dit que le soluté est dissous) forme un mélange homogène appelé solution. Formellement, la dissolution est définie comme le mélange de deux phases avec formation d'une nouvelle phase homogène. Le soluté peut être à l'état solide, liquide ou gazeux. La solution obtenue peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz). La dissolution des solides ioniques dans l'eau s'effectue en trois étapes : - dissociation - solvatation - dispersion. | |
É |
|---|
ÉlectronL'électron, un des composants de l'atome, est une particule élémentaire qui possède une charge électrique négative. | |
électronégatifUn élément électronégatif est un élément qui a tendance à attirer à lui les électrons de liaison dans le cas d'une liaison covalente. | |
E |
|---|
enthalpie de liaisonénergie libérée lors de la formation d’une liaison covalente entre 2 atomes isolés pris à l’état gazeux sous 1 bar et à une température fixée, notée El(C=O) | |
enthalpie standard de formationvariation
d’enthalpie de la réaction de formation d’une mole d’un composé dans son état standard à
partir des corps simples pris dans leur état standard de référence à la
température T. Par convention, l'enthalpie standard de formation des corps simples est prise égale à zéro par convention. | |
entropieL'entropie est une fonction d'état qui permet d'évaluer l'ordre dans un système thermodynamique. Elle s'exprime en (k)J/mol/K. Par définition, l'entropie des corps simples purs à l'état cristallin est nulle à zéro kelvin. | |
É |
|---|
État standardL'état standard d'un composé est l'état physique, réel ou hypothétique, à T et sous P° (1 bar). Il existe donc un état standard pour chaque température.
Pour les composés gazeux : l’état standard est le gaz pur à T et P° se comportant comme un gaz parfait. Pour les composés liquides ou solides : l’état standard est le composé pur respectivement à l’état liquide ou solide à T et P°. Pour les composés en solution : l’état standard est le composé à une concentration de 1 mol/L à T et P°. | |
F |
|---|
facteur de dilutionLe facteur de dilution est une grandeur sans unité supérieure à 1 défini par \(F = \frac{{{C_{mère}}}}{{{C_{fille}}}} = \frac{{{V_{fille}}}}{{{V_{mère}}}} > 1\) Exemple : Si F = 10, la solution fille est 10 fois moins concentrée que la solution mère, la dilution est dite au "dixième". | |
I |
|---|
Ion complexeUn ion complexe est un ion contenant plusieurs atomes. | |
Ion simpleUn ion simple est un ion qui ne contient qu'un seul atome. | |
L |
|---|
liaison covalenteUne liaison covalente est une liaison formée entre deux atomes par une mise en commun de 2 électrons. | |
M |
|---|
masse molaireLa masse molaire, notée MM, représente la masse en g d'une mole d'entités élémentaires (atomes, molécules, ions...). | |
moleUne mole
correspond à la quantité de matière qui contient autant d'entités
élémentaires (atome, molécules, ions) qu'il y a d'atomes dans 12 g de
carbone (isotope 12) | |
MoléculeUne molécule est une structure de base de la matière.Les molécules constituent des agrégats atomiques liés par des forces de valence. | |
N |
|---|
NernstL'équation de Nernst donne le potentiel (E) pris par une électrode plongeant dans une solution contenant l'oxydant (Ox1) et le réducteur (Red1) en fonction du potentiel standard (E°) du couple redox mis en jeu. La formule est la suivante à 25 °C  | |
Nombre d’oxydationLe nombre d'oxydation (n.o.) indique l'état d'oxydation d'un élément dans un ion ou une molécule. Il représente la charge
réelle ou fictive qui serait présente sur un atome d’un élément, si les e– de chaque liaison à cet atome étaient attribués au + électronégatif des atomes liés ; il s’écrit en chiffre romain. | |
O |
|---|
OxydantUn oxydant est un corps simple, une molécule ou un ion qui peut capter au moins un électron lors d'une réaction d'oxydoréduction. | |
OxydationUne oxydation correspond à une perte d'électrons et à une augmentation du nombre d'oxydation. | |
OxydoréductionUne réaction d'oxydoréduction correspond à un échange d'électrons entre l'oxydant d'un couple (Ox1) et le réducteur d'un autre couple (Red2). ATTENTION : le nombre d'électrons cédés par Red2 est égal au nombre d'électrons captés par Ox1. | |
P |
|---|
Potentiel standard (E°)Le potentiel standard (E°) est le potentiel de l'électrode (Nernst) atteint lorsque tous les réactifs et les produits sont dans l'état standard. Il est exprimé par rapport à une référence, l'électrode normale à hydrogène (ENH). | |
protonParticule élémentaire (lourde) de charge positive, qui, avec le neutron, constitue le noyau des atomes. | |
R |
|---|
réaction acido-basiqueUne réaction acido-basique
est un échange de protons entre
un acide qui
cède des protons qui sont captés par une base. | |
Réducteur Un réducteur est un corps simple, une molécule ou un ion qui peut céder au moins un électron lors d'une réaction d'oxydoréduction. | |
RéductionUne réduction correspond à un gain d'électrons et à une diminution du nombre d'oxydation. | |
S |
|---|
solutéUn soluté est une espèce qui se dissout dans un solvant. | |
solutionUne solution est un mélange liquide homogène d'une ou plusieurs substance(s) solide(s), liquide(s) ou gazeuse(s), le soluté, et d'un liquide, le solvant. Les solutions ayant pour solvant l'eau sont nommées solutions aqueuses. | |
solution tamponUne solution tampon est une solution constituée d'un acide faible et de sa base faible conjuguée, dans des concentrations telles que les variations de pH sont négligeables lors de l'ajout de petites quantités d'un acide fort ou d'une base forte ou lors d'une dilution. Une solution tampon est caractérisée par son pH et sa concentration. | |
solvantUn solvant est un composé chimique qui en dissout un autre. Par exemple, l'eau dissout le chlorure de sodium (NaCl), sel de cuisine. | |
spontanéeUne réaction est dite spontanée lorsqu'elle se produit dès que les réactifs sont mis en contact sans apport d'énergie. Du point de vue thermodynamique, ?RG° < 0 (c'est-à-dire que les produits sont thermodynamiquement plus stables que les réactifs). | |
T |
|---|
totaleUne réaction est considérée comme totale (ou quantitative) si plus de 99 % du (ou des) réactif(s) limitant(s) a (ont) réagi. Elle est notée par une simple flèche des réactifs vers les produits. Une réaction est considérée comme totale lorsque la constante d'équilibre est supérieure à 104. | |